1.本发明涉及
湿法冶金技术领域,尤其涉及一种羧酸类化合物作为萃取剂的应用和金属离子萃取方法,特别涉及一种羧酸类化合物作为萃取剂在湿法冶金中的应用和金属离子萃取方法。
背景技术:
2.溶剂萃取法有选择性好、金属回收率高、传质速率快等优点,是工业上
有色金属和
稀土元素等有价金属富集、精炼、分离、纯化等的重要环节,一直以来被众多研究者持续关注并不断发展。但随着环境保护和资源循环利用的迫切性,对萃取体系的能耗、酸耗、排污和产能等性能提出了更高的要求,为了适应更高的需求,性能更优异的萃取剂一直有着强大的现实需求。
3.尽管现今溶剂萃取领域有磷类、胺类、羧酸类等大量萃取剂,但随着社会的发展,现有萃取剂的性能已经不能适应新的原料、待分离组分、环境或经济成本的要求。因此改善现有萃取体系或开发新的萃取体系的相关研究备受重视。例如:p507/p204盐酸体系广泛用于稀土的分离,但p507/p204盐酸体系对重稀土的再生性能差,反萃酸度高,污染严重;c272用于镍钴的分离,但对于新型锂离子电池镍钻锰三元
正极材料的回收方面,c272因在萃取镍前优先萃取钙镁,所以工序复杂;“环烷酸”的性能已不能满足从稀土混合物中萃取分离纯化钇的要求,需要研发能替代环烷酸的萃取剂;胺类萃取剂如n1923,n235等萃取金属过程中会萃取酸,易形成三相,工艺不好控制。
4.相对于磷类和胺类萃取剂,羧酸类用于萃取金属离子最明显的特点是价格低廉、来源丰富、酸耗低,对环境更友好,近年来多种羧酸类萃取剂被报道用于金属的萃取。例如,叔碳羧酸versatic 10和versatic 911(cn110029226a一种从废旧三元锂离子正极材料中回收有价金属方法)等、新癸酸及烃氧基乙酸(cn93112500.6分离稀土金属的萃取剂)。但versatic 10、versatic 911和新癸酸在萃取时无论用于镍钴锰等有色金属的萃取还是用于稀土的萃取,萃取剂在水相中的溶解都较大,造成工艺不稳定、环境污染、成本高、产品提纯困难等;烃氧基乙酸被尝试用于替代环烷酸从稀土元素混合物提取分离钇(y3
+
),但在萃取时会与相改良剂醇发生酯化反应(yanliang wang deqian li et al.separation and purification technology 82(2011)197
–
201),有效的萃取剂浓度会逐渐降低,目前还没有实现工业化应用。
5.上述表明,同磷类、胺类萃取剂相比羧酸类萃取剂具有多方面的独特优势,但目前被报道的羧酸类萃取剂由于其溶解性、稳定性等方面的原因大大限制了其应用或发展,因此新型高效羧酸类萃取剂有重大的应用前景,具有极大的经济、环境和社会价值。
技术实现要素:
6.针对现有技术的不足,本发明的目的之一在于提供一种羧酸类化合物作为萃取剂的应用,尤其在于提供一种羧酸类化合物作为萃取剂在湿法冶金中的应用。所述羧酸类化
合物用作萃取剂,对离子具有较好的选择性,反萃酸度低,且具有稳定性高、水溶性低、成本低等优点。
7.为达此目的,本发明采用如下技术方案:
8.本发明提供一种羧酸类化合物作为萃取剂的应用,所述羧酸类化合物具有式i所示的结构;
[0009][0010]
式i中,10≤m+n≤22,例如11、12、13、14、15、16、17、18、19、20、21等,且m和n均为正整数。
[0011]
所述式i所示的羧酸类萃取剂可从自然界物中提取或通过常规方法合成,用于萃取时萃取剂可为一种或多种羧酸的混合物。
[0012]
示例性的,式i化合物可以参照琼斯氧化反应的方法进行制备,即铬酸在丙酮中将式i化合物对应的醇氧化为羧酸和酮的反应。该反应中的氧化剂也称琼斯试剂,即三氧化铬在浓硫酸中的溶液。式i化合物合成路线如下:
[0013][0014]
优选地,10≤m+n≤20。
[0015]
优选地,所述m和n各自独立地为2~20的整数,例如3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19等。
[0016]
优选地,所述m和n各自独立地为2~10的整数。
[0017]
优选地,所述羧酸类化合物包括如下化合物中的任意一种或至少两种组合:
[0018][0019]
优选地,所述羧酸类化合物应用于金属离子的萃取分离。
[0020]
本发明优选将式i所述的萃取剂用于萃取金属离子,这是由于式i化合物的特点于羧基α位的仲碳,区别于α位的伯碳羧酸和α位的叔碳羧酸,仲碳羧酸的存在带来了恰当的位阻,对离子有较好的选择性,从而实现金属离子有效的萃取分离。
[0021]
优选地,所述金属离子包括fe
3+
、al
3+
、cu
2+
、zn
2+
、cd
2+
、ni
2+
、co
2+
、mn
2+
、ca
2+
、mg
2+
、li
+
、na
+
、k
+
、cr
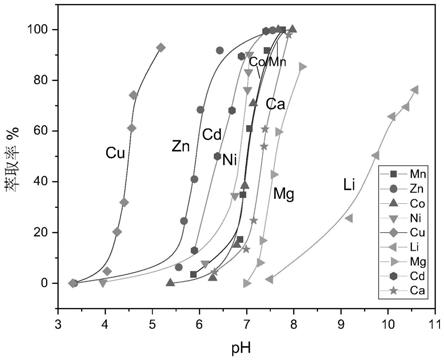
3+
、ga
3+
、in
3+
、ti
4+
、sc
3+
、y
3+
、la
3+
、ce
3+
、pr
3+
、nd
3+
、sm
3+
、eu
3+
、gd
3+
、tb
3+
、dy
3+
、ho
3+
、
er
3+
、tm
3+
、yb
3+
或lu
3+
中的任意一种或至少两种组合。
[0022]
在不违背本领域常识的基础上,萃取分离上述元素会有料液中常规离子相伴,以上各优选条件,可任意组合,即得本发明各较佳实例。
[0023]
优选地,所述金属离子包括有色金属离子和/或稀土金属离子。
[0024]
优选地,所述萃取分离中,被萃取料液中与所述金属离子配伍的阴离子包括cl
—
、so
42—
或no
3—
中的任意一种或至少两种组合。
[0025]
优选地,所述羧酸类化合物应用于废锂离子电池正极材料、含镍钴废渣或镍红土矿中金属离子的萃取分离。
[0026]
本发明的目的之二在于提供一种萃取有机相,所述萃取有机相中含有式i所示的羧酸类化合物;
[0027][0028]
式i中,10≤m+n≤22,例如11、12、13、14、15、16、17、18、19、20、21等,且m和n均为正整数。
[0029]
优选地,所述萃取有机相中还含有稀释剂。
[0030]
优选地,所述萃取有机相中还含有稀释剂,优选所述稀释剂包括溶剂油、煤油、甲苯、escaid 110、己烷、庚烷或十二烷中的任意一种或至少两种组合;所述溶剂油包括200号或260号溶剂油(即磺化煤油),所述的十二烷为正十二烷。
[0031]
优选地,所述萃取有机相中,式i所示的羧酸类化合物的浓度为0.1~2.0mol/l,例如0.2mol/l、0.3mol/l、0.4mol/l、0.8mol/l、1.0mol/l、2.0mol/l等。
[0032]
本发明的目的之三在于提供一种金属离子萃取方法,所述萃取方法包括如下步骤:
[0033]
采用含有目的之二所述的萃取有机相对含有金属离子的萃取相进行萃取,对得到的负载有机相进行反萃,得到金属离子富集溶液和再生有机相。
[0034]
优选地,所述反萃的反萃剂包括盐酸和/或硫酸。
[0035]
优选地,所述反萃所用盐酸浓度为1~4mol/l,例如1.5mol/l、2mol/l、2.5mol/l、3mol/l、3.5mol/l等。
[0036]
优选地,所述反萃所用硫酸浓度为0.5~4mol/l,例如1mol/l、2mol/l、3mol/l等。
[0037]
优选地,所述萃取有机相和萃取相的体积比(o/a)为1:10~10:1,例如2:9、3:8、4:7、5:6、6:5、7:4、8:3、9:2等。
[0038]
优选地,所述负载有机相和反萃剂的体积比(o/a)为1:10~10:1,例如2:9、3:8、4:7、5:6、6:5、7:4、8:3、9:2等,反萃一次或多次。
[0039]
相较于现有技术,本发明具有如下有益效果:
[0040]
(1)式i所示的萃取剂在应用于金属离子的萃取分离时,分离系数高(与versatic 10相比,分离系数高约20~30%),反萃酸度低(1.0mol/l盐酸进行反萃的反萃率>99%),负载率高(对ni
2+
的饱和容量约为16.9g/l)等;
[0041]
(2)式i所示的羧酸类化合物稳定性高、水溶性低(在萃取体系平衡ph=8~9时所提取出油含量在100mg/l左右),使得萃取工艺稳定,可以减少环境污染、降低成本;
[0042]
(3)式i所示的萃取剂成本低,有重大的应用前景,可用于三元电池回收、电池级硫酸镍制备等多种体系。
附图说明
[0043]
图1是实施例1中萃取剂191对各个离子的萃取率e%-ph曲线。
[0044]
图2是实施例2中萃取剂195对各个离子的萃取率e%-ph曲线。
[0045]
图3是实施例3中o/a为5:1条件下萃取剂196对各个离子的萃取率e%-ph曲线。
[0046]
图4是实施例3中o/a为8:1条件下萃取剂196对各个离子的萃取率e%-ph曲线。
[0047]
图5是实施例4中萃取剂196对各个离子的萃取率e%-ph曲线。
[0048]
图6是实施例5中萃取剂191对镍和镁离子的萃取率e%-ph曲线。
[0049]
图7是对比例4中硬脂酸对各个离子的萃取率e%-ph曲线。
具体实施方式
[0050]
为便于理解本发明,本发明列举实施例如下。本领域技术人员应该明了,所述实施例仅是帮助理解本发明,不应视为对本发明的具体限制。
[0051]
以下实施例实验所用涉及来源信息:
[0052]
产品酸含量的电位滴定,按照文献:袁承业,胡水生;有机磷化合物的研究xvi磷化合物的长碳链烷基及烷氧基的σ
p
常数与集团连通性[j].化学学报,1986,44,590-596,进行;电位滴定仪:瑞士万通907titrando。
[0053]
本发明实施例中,水相按常规方法制备,制备方法为称取一定质量的盐(盐的选择根据反萃所用的酸而定,例如反萃使用硫酸,则选择的硫酸盐铁),溶于去离子水中,稀释到一定的浓度即可。
[0054]
本发明实施例中,“皂化”是指将羧酸萃取剂中的氢离子转化为碱金属离子和/或nh
4+
(与金属离子进行交换,实现萃取的作用),皂化的比例指的是碱金属和/或nh
4+
占原有的氢离子的比例,其步骤为:将有机相与碱的水溶液混合即可。所述的碱的水溶液的摩尔浓度为6mo1/l~14mol/l,所述的碱可为本领域常规的碱,较佳地为无机碱和/或有机碱。所述的无机碱较佳地为氢氧化钠和/或氢氧化钾。所述的有机碱较佳地为氨水。
[0055]
本发明实施例中,萃取后,水相中金属离子浓度使用电感藕合等离子体发射光谱法(icp-oes)分析,有机相中金属离子浓度通过差减法计算。
[0056]
以下实施例中没有提供制备方法的原料均市售可得。
[0057]
以下合成例1示例性地给出式i所示的羧酸类化合物的具体制备方法和表征数据。
[0058]
合成例1
[0059]
萃取剂196的合成:
[0060]
步骤:在圆底烧瓶中加入153g十六醇(约200ml),加入1.5倍体积300ml丙酮,缓慢加入琼斯试剂,开始温度8℃,加入后溶液变为绿色,待温度上升为14℃,降低滴加速度,温度恒定为14℃,温度下降为13℃时,加快滴加速度,并不断搅拌,温度上升说明反应还在继续,同时可以观察溶液不分相,加冰后温度稳定在15℃,加快搅拌,温度会继续上升,停止搅拌温度在19℃稳定,点板得到产物,产物用二氯甲烷溶解,再分别用稀酸、稀碱以及蒸馏水洗涤,油水分离后旋蒸二氯甲烷,得到萃取剂196。
[0061]
表征数据:
13
c nmr(101mhz,cdcl3)δ183.50(s),77.43
–
76.83(m),76.67(s),45.65(s),32.31
–
31.38(m),29.37(dd,j=25.0,8.9hz),27.35(d,j=3.4hz),22.63(d,j=5.9hz),14.02(d,j=4.4hz);1h nmr(400mhz,cdcl3)δ2.24(1h),1.70(4h),1.45(20h),0.85(6h);ms:256.2.
[0062]
实施例1
[0063]
萃取剂191对有色金属离子的萃取性能:
[0064]
萃取剂191结构为:(m=10,n=6,酸含量90%)。
[0065]
萃取剂191溶解于十二烷配制成0.2mol/l有机相,分别配置0.01mol/l的cu
2+
、zn
2+
、cd
2+
、ni
2+
、co
2+
、mn
2+
、ca
2+
、mg
2+
、li
+
的硫酸盐溶液作为水相。在有机相比水相为1:1的相比的条件下,通过6mol/l氢氧化钠皂化控制ph(表1),萃取后,得到萃取剂191对各个离子的萃取率e%-ph曲线(图1),萃取剂191对于各离子之间的分离系数如表2所示。
[0066]
表1:萃取剂191对各离子萃取ph
1/2
[0067] cu
2+
zn
2+
cd
2+
ni
2+
co
2+
mn
2+
ca
2+
mg
2+
li
+
ph
1/2
4.495.916.386.857.007.017.327.599.75
[0068]
表2:萃取剂191对各离子之间的分离系数
[0069][0070][0071]
由表2可知,萃取剂191萃取分离各离子cu
2+
、zn
2+
、cd
2+
、ni
2+
、co
2+
、mn
2+
、ca
2+
、mg
2+
、li
+
之间的分离系数都大于1,可以实现分离。
[0072]
图1显示萃取剂191对镍钴离子的萃取顺序先于钙镁,且镍钴与镁分离系数高,因此该萃取剂可应用于有色金属离子与杂质金属离子分离。
[0073]
实施例2
[0074]
萃取剂195对三价离子的萃取性能:
[0075]
萃取剂195的结构为:(m=7,n=5,酸含量93%)。
[0076]
萃取剂195溶解于甲苯配制成0.1mol/l有机相,分别配置0.005mol/l的fe
3+
、ga
3+
、in
3+
、sc
3+
、cr
3+
、al
3+
、lu
3+
、ho
3+
、gd
3+
的氯化盐溶液作为水相。在有机相比水相为1:1的相比的条件下,通过8mol/l氢氧化钠皂化控制ph(表3),萃取后,得到萃取剂195对各个离子的萃取率e%-ph曲线(图2)。
[0077]
表3:萃取剂195对各离子萃取ph
1/2
[0078][0079][0080]
表4:萃取剂195对各离子之间的分离系数
[0081] fe
3+
ga
3+
in
3+
sc
3+
cr
3+
lu
3+
ho
3+
ga
3+
95.50
??????
in
3+
177.831.86
?????
sc
3+
1230.2712.886.92
????
cr
3+
1862.0919.5010.471.51
???
al
3+
95499.261000.00537.0377.6251.29
??
ho
3+
/////3.98 gd
3+
/////15.853.98
[0082]
由图2和表4可知,萃取剂195萃取分离各离子fe
3+
、ga
3+
、in
3+
、sc
3+
、cr
3+
、al
3+
、lu
3+
、ho
3+
、gd
3+
之间的分离系数都大于1,能将各个稀土离子有效分离,说明该萃取剂可应用于分离稀土离子。
[0083]
实施例3
[0084]
萃取剂196对电池料液中ni/co/mn/ca/mg混合离子的萃取性能:
[0085]
萃取剂196的结构为:(m=6,n=8所对应的化合物,通过醇的氧化获得,酸含量97%)。
[0086]
萃取剂196溶解于escaid 110配制成0.6mol/l有机相,电池料液中含有ni(46.20g/l),co(20.56g/l),mn(23.93g/l),ca(0.43g/l),mg(0.21g/l),在有机相(o)比水相(a)为5:1和8:1的相比的条件下,通过10mol/l的naoh皂化控制ph,萃取后,得到萃取剂196对各个离子的萃取率e%-ph曲线(图3和图4)。
[0087]
图3和图4中显示,196在电池料液体系中,在ph<7.2时选择性的萃取ni、co、mn,与ca、mg的分离度较高;当o/a为8:1、ph>6.8时(图4),可将电池料液中的ni、co、mn几乎完全萃取,同时ca、mg的萃取率较低。此实验证明,萃取剂196在电池镍钴锰三元正极材料的回收方面有可行性的应用价值。
[0088]
实施例4
[0089]
萃取剂196对稀土离子萃取性能:
[0090]
萃取剂196溶解于十二烷配制成2mol/l有机相,配置混合离子la
3+
、ce
3+
、nd
3+
、y
3+
、yb
3+
氯化盐溶液,各个离子的浓度为0.01mol/l。在有机相比水相为1:1的相比的条件下,通过10mol/l氨水皂化控制ph,萃取后,得到萃取剂196对各个离子的萃取率e%-ph曲线,如图5所示。
[0091]
由图5可以看出,萃取剂196对稀土离子的萃取能力从重稀土到轻稀土逐渐减弱,萃取顺序同p507一致,可实现对稀土离子的分离。
[0092]
实施例5
[0093]
萃取剂191对高镁氯化镍料液的萃取:
[0094]
萃取剂191溶解于十二烷配制成0.31mol/l有机相,水相为含1.33g/l ni和4g/l mg的高镁氯化镍料液,在有机相比水相为1:1的相比的条件下,通过10mol/l naoh皂化控制ph,萃取后,得到萃取剂191对镍和镁离子的萃取率e%-ph曲线,如图6所示。
[0095]
由图6可知,萃取剂191对镍的萃取顺序在镁之前,镍和镁的分离系数大约为833,由此说明萃取剂191可实现对镍和镁的分离。
[0096]
实施例6
[0097]
萃取剂199对稀土离子萃取性能:
[0098]
萃取剂199为一种混合型萃取剂,由如下四种化合物组成:
[0099]
(m为8,n为2,m+n=10)、(m为7,n为9,m+n=16)、(m为10,n为8,m+n=18)、(m为10,n为10,m+n=20)。
[0100]
萃取剂199中上述四种化合物的体积比为1:1:1:1,酸含量92.6%。
[0101]
萃取剂199溶解于十二烷配制成0.2mol/l有机相,配置混合离子la
3+
、ce
3+
、nd
3+
、y
3+
、yb
3+
硝酸盐溶液,各个离子的浓度为0.01mol/l。相比o/a为1:1,通过10mol/l氢氧化钾皂化30%,对各离子的萃取率如下表5:
[0102]
表5:萃取剂199对各离子的萃取率
[0103] nd
3+
ce
3+
yb
3+
la
3+
y
3+
ph=3.8923.5817.2613.8710.589.47
[0104]
由表5可以看出,萃取剂199则是先萃取除y
3+
以外的稀土离子,有望替代结构和性能不稳定的环烷酸。
[0105]
实施例7
[0106]
萃取剂196对ni
2+
饱和容量测试:
[0107]
实验方法:取一个50ml分液漏斗,加入0.6mol/l的196-十二烷有机相10ml,用10mol/l的naoh皂化60%,加入50g/l的niso4水相10ml,振荡混合15min;分出水相,再加入新鲜50g/l的niso4水相10ml,振荡混合15min;重复前述操作直至水相中离子浓度不在发生
变化,此时有机相中金属的浓度为萃取剂的饱和容量。反萃有机相得萃取剂196对ni
2+
的饱和容量约为16.9g/l。
[0108]
实施例8
[0109]
萃取剂192负载稀土离子后的反萃性能:
[0110]
萃取剂192的结构为:(m=8,n=2,通过醇的氧化获得,酸含量95%)。
[0111]
萃取剂192溶解于十二烷配制成0.6mol/l有机相,配置0.30mol/l的lu
3+
氯化盐溶液,用9mol/l氨水皂化60%萃取得负载0.10mol/l lu的192有机相,在有机相比水相为1:1的相比的条件下用1.0mol/l盐酸对有机相进行反萃,反萃率>99%,而负载lu的p507有机相一般用4mol/l盐酸反萃,一次反萃率约80%。上述结果证明式i所示的羧酸化合物应用于萃取稀土金属时,在较低反萃酸度的前提下能够获得较高的反萃率。
[0112]
萃取剂194和萃取剂versatic 10在萃取体系中的溶解性实验(实施例9和对比例1):
[0113]
实施例9
[0114]
萃取剂194的结构为:(m=6,n=6,通过醇的氧化获得,酸含量99%)。
[0115]
萃取:将萃取剂194与稀释剂escaid 110配置成0.62mol/l溶液,水相为0.2mol/l niso4溶液,取一个250ml分液漏斗,加入100ml有机相,加入14mol/l氢氧化钠皂化70%,加入水相100ml,萃取平衡30min。
[0116]
油含量测试:分出水相加入h2so4,此时水相溶液[h
+
]浓度约为1mol/l。用ch2cl2萃取(30ml
×
3),萃取收集ch2cl2层,用1g无水na2so4干燥除ch2cl2中的水,过滤,滤液旋蒸,再用油泵干燥30min。通过称量旋蒸前后烧瓶的重量得出体系ch2cl2萃取出的油含量。
[0117]
对比例1
[0118]
与实施例9的区别在于,将萃取剂194替换为萃取剂versatic 10(市售,酸含量98%)。
[0119]
实施例9和对比例1的测试结果如表6所示。
[0120]
表6:萃取剂194和versatic 10在萃取体系中的溶解度
[0121][0122]
通过以上实验可知,稀释剂空白(不添加萃取剂,其他操作步骤均与实施例8相同)
与水相平衡后所提取出油含量46mg/l,萃取剂194在萃取体系平衡ph=8~9时所提取出油含量在100mg/l左右,而versatic 10在萃取体系平衡ph约为8时所提取出油含量在6000mg/l左右,萃取体系中versatic 10的溶解损失很大,易造成工艺运行不稳定。式i所示的羧酸类化合物用于金属离子萃取分离时,解决了萃取剂在水相中溶解度较大的问题,工艺运行稳定,运行成本可以降低约60倍。
[0123]
萃取剂195和萃取剂versatic 911在萃取体系中的溶解性实验(实施例10和对比例2):
[0124]
实施例10
[0125]
将萃取剂195与稀释剂escaid110配置成0.62mol/l溶液,水相为含1.33g/l ni和4g/l mg的高镁氯化镍料液,取一个250ml分液漏斗,加入100ml有机相,加入10mol/l氢氧化钠皂化24%,加入水相100ml,萃取平衡30min。
[0126]
油含量测试:分出水相加入h2so4,此时水相溶液[h
+
]浓度约为1mol/l。用ch2cl2萃取(30ml
×
3),萃取收集ch2cl2层,用1g无水na2so4干燥除ch2cl2中的水,过滤,滤液旋蒸,再用油泵干燥30min。通过称量旋蒸前后烧瓶的重量得出体系ch2cl2萃取出的油含量。
[0127]
对比例2
[0128]
与实施例10的区别在于,将萃取剂195替换为萃取剂versatic 911(市售,酸含量98%)。
[0129]
实施例10和对比例2的测试结果如表7所示。
[0130]
表7:萃取剂195和versatic 911在萃取体系中的溶解度
[0131][0132]
通过以上实验可知,稀释剂空白(不添加萃取剂,其他操作步骤均与实施例10相同)与水相平衡后所提取出油含量46mg/l,萃取剂195在萃取体系平衡ph约为7.3时所提取出油含量在75mg/l左右,而versatic 911油含量在4680mg/l左右,萃取体系中versatic 911的溶解损失很大。式i所示的羧酸类化合物用于金属离子萃取分离时,解决了萃取剂在水相中溶解度较大的问题,工艺稳定,降低运行成本。
[0133]
对比例3
[0134]
与实施例1的区别在于,将萃取剂191替换为萃取剂versatic 10(市售,酸含量98%)。
[0135]
实施例1和对比例3的测试结果如表8所示。
[0136]
表8:萃取剂191和versatic 10对各离子的分离系数
[0137][0138]
由表8可知,相同实验条件下,与versatic 10相比,萃取剂191对各离子的分离系数较高,高约20~30%。在半萃ph下,萃取剂191对ni/mg和ni/zn的分离系数分别为30.2和75.86,而versatic 10对ni/mg和ni/zn的分离系数分别为23.00和57.89,由此说明萃取剂191相比于versatic 10对离子有更好的分离效果。
[0139]
对比例4
[0140]
与实施例3的区别在于,将萃取剂196替换十八个碳带支链的硬脂酸(英国禾大(corda)异硬脂酸3501,prisorine 3501),该萃取剂溶解于escaid 110配制成0.6mol/l有机相,电池料液中含有ni(46.20g/l),co(20.56g/l),mn(23.93g/l),ca(0.43g/l),mg(0.21g/l),在有机相(o)比水相(a)为8:1的相比的条件下,通过10mol/l的naoh皂化控制ph,萃取后,得到异硬脂酸对各个离子的萃取率e%-ph曲线(图7)。观察实验现象,该萃取剂在电池料液体系中,当水相平衡ph大于5.33时,分相现象变差,水相呈浑浊粘稠状态,有机相颜色逐渐为无色;由图7可知,当水相平衡ph大于5.33时,该萃取剂对金属离子的萃取能力下降,以上结果表明萃取剂硬脂酸在电池镍钴锰三元正极材料的回收方面可行性不好。
[0141]
对比例5
[0142]
与实施例3的区别在于,将萃取剂196替换为十六个碳直链的软脂酸,其他步骤和参数均相同,结果表明软脂酸在escaid 110中溶解度不好,无法进行萃取实验。
[0143]
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。技术特征:
1.一种羧酸类化合物作为萃取剂的应用,其特征在于,所述羧酸类化合物具有式i所示的结构:式i中,10≤m+n≤22,且m和n均为正整数。2.根据权利要求1所述的应用,其特征在于,10≤m+n≤20。3.根据权利要求1或2所述的应用,其特征在于,所述m和n各自独立地为2~20的整数。4.根据权利要求1~3中任一项所述的应用,其特征在于,所述m和n各自独立地为2~10的整数。5.根据权利要求1~3中任一项所述的应用,其特征在于,所述羧酸类化合物包括如下化合物中的任意一种或至少两种组合:6.根据权利要求1~5中任一项所述的应用,其特征在于,所述羧酸类化合物应用于金属离子的萃取分离;优选地,所述金属离子包括fe
3+
、al
3+
、cu
2+
、zn
2+
、cd
2+
、ni
2+
、co
2+
、mn
2+
、ca
2+
、mg
2+
、li
+
、na
+
、k
+
、cr
3+
、ga
3+
、in
3+
、ti
4+
、sc
3+
、y
3+
、la
3+
、ce
3+
、pr
3+
、nd
3+
、sm
3+
、eu
3+
、gd
3+
、tb
3+
、dy
3+
、ho
3+
、er
3+
、tm
3+
、yb
3+
或lu
3+
中的任意一种或至少两种组合。7.根据权利要求6所述的应用,其特征在于,所述金属离子包括有色金属离子和/或稀土金属离子。8.根据权利要求6或7所述的应用,其特征在于,所述萃取分离中,被萃取料液中与所述金属离子配伍的阴离子包括cl
—
、so
42—
或no
3—
中的任意一种或至少两种组合;优选地,所述羧酸类化合物应用于废锂离子电池正极材料、含镍钴废渣或镍红土矿中金属离子的萃取分离。9.一种萃取有机相,其特征在于,所述萃取有机相中含有式i所示的羧酸类化合物;式i中,10≤m+n≤22,且m和n均为正整数;优选地,所述萃取有机相中还含有稀释剂;优选地,所述萃取有机相中,式i所示的羧酸类化合物的浓度为0.1~2.0mol/l。
10.一种金属离子萃取方法,其特征在于,所述萃取方法包括如下步骤:采用权利要求9所述的萃取有机相对含有金属离子的萃取相进行萃取,对得到的负载有机相进行反萃,得到金属离子富集溶液和再生有机相;优选地,所述反萃的反萃剂包括盐酸和/或硫酸;优选地,所述反萃所用盐酸浓度为1~4mol/l;优选地,所述反萃所用硫酸浓度为0.5~4mol/l;优选地,所述萃取有机相和萃取相的体积比为1:10~10:1;优选地,所述负载有机相和反萃剂的体积比为1:10~10:1。
技术总结
本发明涉及一种羧酸类化合物作为萃取剂的应用和金属离子萃取方法,所述羧酸类化合物具有式I所示的结构。式I所示的萃取剂的特点于羧基α位的仲碳,区别于α位的伯碳羧酸和α位的叔碳羧酸,仲碳羧酸的存在带来了恰当的位阻,对离子有较好的选择性,用于金属离子的萃取分离时,分离系数高,反萃酸度低,负载率高;并且,式I的羧酸类化合物稳定性高、水溶性低,使得萃取工艺稳定,可以减少环境污染、降低成本,具有重大的应用前景。具有重大的应用前景。具有重大的应用前景。
技术研发人员:王雪
受保护的技术使用者:北京博萃循环科技有限公司
技术研发日:2020.05.27
技术公布日:2021/12/2
声明:
“羧酸类化合物作为萃取剂的应用和金属离子萃取方法与流程” 该技术专利(论文)所有权利归属于技术(论文)所有人。仅供学习研究,如用于商业用途,请联系该技术所有人。
我是此专利(论文)的发明人(作者)

 957
编辑:中冶有色技术网
来源:北京博萃循环科技有限公司
957
编辑:中冶有色技术网
来源:北京博萃循环科技有限公司

 举报 0
举报 0
 收藏 0
收藏 0
 反对 0
反对 0
 点赞 0
点赞 0

